Dutasterida e finasterida na terapêutica para tratamento da HPB
O câncer de próstata é o segundo câncer mais comum e a terceira causa de mortes entre homens em todo o mundo. O aumento do antígeno prostático especifico (PSA) logo após a retirada da próstata (prostactomia), indica uma falha na eliminação completa do câncer de próstata e níveis de PSA aumentados posterior aponta falha no tratamento da hiperplasia prostática benigna (HULIN-CURTIS et al., 2010; SHIN et al., 2017).
A dutasterida e a finasterida são inibidores competitivos da 5α-redutase, comumente usadas no tratamento da hiperplasia prostática benigna, pois a 5α-redutase são responsáveis pela conversão da testosterona em di-hidrotestosterona, fator importante para a progressão da HPB (JUN et al., 2017).
Ao bloquear a 5α-redutase é reduzida a concentração serica de di-hidrotestosterona, inibindo o crescimento prostático, reduzindo a progressão da hiperplasia (JUN et al., 2017).
O desenvolvimento e a diferenciação do tecido prostático é regulado pelos hormônios androgênicos e a modulação é feita pelo receptor de androgênio (AR).
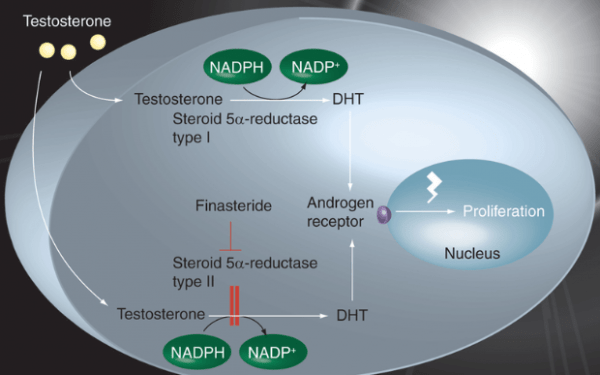
A testosterona é irreversivelmente convertida em uma reação de redução dependente de nicotinamida-adenina-dinucleotídeo fosfato (NADPH) forma fisiologicamente ativa da 5α-di-hidrotestosterona (DHT). Sendo mediada pelas isoenzimas 5α-redutase I e II no tecido da próstata (HULIN-CURTIS et al., 2010).
A privação de andrôgenios pode ser uma opção terapêutica para estes pacientes que apresentaram falha no tratamento do câncer de próstata, no processo de ressecção. Os inibidores de 5-alfa-redutase (5-ARI) reduzem os níveis de PSA em um percentual de 50% a 66%. Estudos tem apontado que o tratamento com dutasterida reduz o risco de câncer de próstata (SHIN et al., 2017).
Os androgênios, testosterona e diidrotestosterona, além de desempenhar um importante papel no desenvolvimento e crescimento da próstata, é também responsável pelo desenvolvimento e progressão da hiperplasia prostática benigna (HPB) e câncer de próstata. Entretanto, as ações desses hormônios podem ser antagonizadas pela inibição da conversão da testosterona em diidrotestosterona pela inibição da 5α-redutase (AMARAM et al., 2013; HULIN-CURTIS et al., 2010).
Esta tem sido uma abordagem terapêutica útil para as doenças citadas. Estes esteróides inibidores da enzima 5-alfa-redutase tipo I e II, finasterida e dutasterida, são utilizados na clínica para o tratamento da HPB e na quimioprevenção do câncer de próstata. O esteróide 5α-redutase tipo I é expresso principalmente no fígado, pele e, em menor grau, na próstata. O esteróide 5α-redutase tipo II é abundantemente expresso na próstata e minimamente expresso no fígado e na pele (AMARAM et al., 2013; Kang et al., 2017; HULIN-CURTIS et al., 2010).
Estudos têm mostrado que a dutasterida é efetiva, segura e bem tolerada para o tratamento, tanto em monoterapia quanto em combinação com α-bloqueadores (WU & KAPOOR, 2013; SHIN et al., 2017).
Estudos apontaram que o uso de monoterapia precoce com dutasterida levou a uma redução nos níveis séricos de PSA naqueles homens com os índices de PSA elevados após a prostectomia. A dutasterida pode atrasar as alterações nos níveis do antígeno prostático especifico. No entanto, como a diidrotestosterona (DHT) é o andrógeno mais potente da próstata, a inibição da 5-alfa-redutase, que convertem a testosterona em DHT, pode ser um alvo apropriado para o tratamento da hiperplasia prostática benigna (SHIN et al., 2017).
Além disso, a monoterapia a dutasterida, leva a inibição 5-alfa-redutase, podendo atuar na prevenção do câncer de mama, podendo apresentar complicações mínimas, dessa forma, pode ser uma boa opção terapêutica em homens submetidos a cirurgia para retirada da próstata (SHIN et al., 2017).
Finasterida
A finasterida é inibidor seletivo da 5α-redutase tipo II. Pode atuar retardando os níveis de PSA em pacientes que tiveram cirúrgia para retirada da próstata (SHIN et al., 2017; HULIN-CURTIS et al., 2010; JUN et al., 2017).
A finasterida é potencialmente efetiva na quimioprevenção, reduzindo o risco de hiperplasia prostática benigna.
O tratamento com finasterida inibe o câncer de próstata de baixo grau, reduz o volume da próstata e, ao fazê-lo, aumenta a taxa de detecção de tumores de alto grau. A finasterida é um potente inibidor competitivo da 5α-redutase tipo II, consegue ainda fazer ainda a inibição da 5α-redutase tipo I, embora, de uma forma mais lenta (HULIN-CURTIS et al., 2010).
Dutasterida
A dutasterida é um inibidor duplo da 5α-redutase. Inibe as duas isoenzimas da 5α-redutase, tipo I e tipo II, sendo estas, as responsáveis pela conversão de testosterona em 5α-di-hidrotestosterona (DHT), o principal androgênio responsável pela hiperplasia do tecido prostático glandular.
A dutasterida atua no tratamento e na prevenção da progressão da hiperplasia benigna da próstata, ainda reduz o tamanho da próstata e diminui o risco de retenção urinária, reduzindo também a necessidade de cirúrgia para a prostactomia (Kang et al., 2017; JUN et al., 2017).
Os efeitos da dutasterida sobre a redução da DHT, é dose dependente, pode-se observar resultados significativos após 1 ou 2 semanas de uso. Após 1 semana de administração diária de 0,5 mg pode-se perceber uma redução de 85% dos níveis de DHT e após 2 semanas a redução foi de 90% (Kang et al., 2017).
O uso da dutasterida resulta em involução da próstata e perda de células epiteliais por apoptose. A administração exógena de andrógenos induz a recuperação da função e do tamanho da próstata, por meio de rápida proliferação e diferenciação de células basais (HULIN-CURTIS et al., 2010).
Estudos utilização de dutasterida e finasterida
Um estudo realizado durante 4 anos, onde 1617 homens com próstata em tamanho >40mL e pontuação nas bases no sintoma internacional de próstata (SIP) < 8, participaram do estudo e foram divididos para receber placebo ou dutasterida 0,5mg diário.
825 participantes fizeram uso de placebo e 792 de dutasterida. Um total de 464 (29%) dos pacientes apresentou progressão clinica da HPB, destes 297 (36%) utilizaram placebo, e 167 (21%) fizeram o uso de dutasterida (TOREN et al., 2013).
A redução do risco relativo foi de 41% e a redução do risco absoluto foi de 15%. Entre os homens que apresentaram retenção urinária aguda e cirurgia relacionada à HPB, a redução do risco absoluto com a dutasterida foi de 6% para a retenção urinária aguda e de 3,8% para a ocorrência de cirurgia.
Na análise de regressão multivariada, o fármaco reduziu significativamente a progressão clínica da HPB em. Os resultados do estudo mostram que a dutasterida é eficaz para a redução da incidência da hiperplasia (TOREN et al., 2013).
Um estudo prospectivo foi conduzido com 52 pacientes com HPB que não obtiveram resultados satisfatórios com monoterapia com antagonista alfa-adrenérgico. Os critérios adotados no estudo para inclusão dos pacientes foi a presença de volume de próstata >30mL e os índices internacionais de sintomas de próstata (IISP) ≥8. O tratamento com a dutasterida melhorou significativamente os IISP (WADA et al., 2013).
41 pacientes que apresentavam hiperatividade do detrusor antes da adição de dutasterida ao tratamento, mostraram aparente redução na amplitude de contração involuntária do detrusor após o tratamento com dutasterida, incluindo 7 pacientes que apresentaram desaparecimento da hiperatividade do detrusor.
O tratamento resultou em diminuição do volume da próstata de 66,4±31,9 para 47,6±26,1 mL e da obstrução da bexiga, melhorando os sintomas e as conseqüências da hiperplasia (WADA et al., 2013).
Estudos clínicos têm demonstrado que a combinação dutasterida (0,5mg/dia) e tansulosina (0,4mg/dia) é mais efetiva que a monoterapia, no tratamento da HPB sintomática. A tansulosina é um antagonista alfa adrenérgico, que atua reduzindo a pressão da musculatura da próstata e da uretra, e desse modo, promove melhora no fluxo urinário (ISMAILA et al., 2013).
Um estudo recente avaliou e comparou os efeitos terapêuticos e os níveis de variação de PSA quando em tratamento utilizado em associação com finasterida e tansulosina ou dutasterida e tansulosina, para hiperplasia prostática benigna por 2 anos, e o risco de desenvolver câncer de próstata em pacientes com PSA<4ng/mL.
Os 288 pacientes com HPB foram separados em dois grupos e analisados (ARENA, 2013).
Os resultados apontaram que ambos os tratamentos reduziram significativamente a PSA e o volume da próstata. A comparação entre os 2 grupos de tratamento mostraram uma diferença significativa em 3 meses no IISP e volume de próstata no grupo tratado com dutasterida, mas em 6 meses de tratamento esta diferença não foi significativa (ARENA, 2013).
Os pacientes que apresentaram redução de mais da metade de PSA, mostraram boa resposta ao tratamento e não foi necessária a terapia cirúrgica. Os inibidores da 5α-redutase no tratamento da HPB foram eficazes em reduzir a PSA e o volume da próstata, em 3 meses com a dutasterida e em 6 meses com a finasterida, sendo alternativas seguras (ARENA, 2013).
A terapia combinada com dutasterida e tansulosina não só proporciona melhor melhora dos sintomas e taxa de fluxo urinário, mas também está associada com um impacto mais favorável sobre a qualidade de vida e satisfação do paciente com o tratamento que a monoterapia.
A terapia de combinação também reduz o risco de eventos relacionados com a progressão da doença, tais como retenção urinária aguda e cirurgia de hiperplasia benigna da próstata relacionado (DJAVAN et al., 2013).
Outro estudo realizado com 325 homens asiáticos e 4259 homens caucasianos, reafirma em seus resultados a eficácia da combinação (dutasterida + tansulosina) no tratamento da HPB. A incidência de retenção urinária aguda ou cirurgia de hiperplasia benigna da próstata relacionado não diferiu significativamente entre os grupos de tratamento na subpopulação asiática (CHUNG et al., 2012).
Nos homens caucasianos, a incidência de retenção urinária aguda / cirurgia de hiperplasia benigna da próstata relacionado foi significativamente menor no grupo de terapia de combinação em comparação com o grupo de monoterapia com tansulosina (P <0,001), mas não em comparação com a monoterapia dutasterida (CHUNG et al., 2012).
A terapia combinada aumentou significativamente o tempo para a progressão clínica da hiperplasia prostática benigna e resultaram em melhoria nos escores internacional dos sintomas da próstata, na taxa máxima de fluxo urinário, qualidade de vida, e redução do volume da próstata nos homens asiáticos e caucasianos que receberam terapia combinada, comparado com monoterapia com tansulosina (CHUNG et al., 2012).
Um recente estudo mostra que a obesidade pode estar relacionada com o aumento do volume da próstata e pode atenuar a redução do volume pela dutasterida.
A interação nula entre dutasterida e obesidade nas mudanças do volume prostático, aponta que o efeito da obesidade no tratamento com dutasterida em homens é como uma combinação do efeito da dutasterida em reduzir o volume prostático, com a ação da obesidade em estimular seu crescimento, e não a diminuição da efetividade do fármaco (MULLER et al., 2013).
Referências
- Amaral C, Varela C, Correia-da-silva G, Tavares da Silva E, Carvalho RA, et al. New steroidal 17β-carboxy derivatives present anti-5α-reductase activity and anti-proliferative effects in a human androgen-responsive prostate cancer cell line. Biochimie. S0300-9084(13), 00246-50, 2013.
- Arena F. Specific antigen prostatic changes during treatment with finasteride or dutasteride for benign prostatic hyperplasia. Minerva Urol Nefrol. 65(3), 211-16, 2013.
- Chung BH, Lee SH, Roehrborn CG, Siami PF, et al. Comparison of the response to treatment between Asian and Caucasian men with benign prostatic hyperplasia: long-term results from the combination of dutasteride and tamsulosinstudy. Int J Urol. 19(11), 1031-35, 2012.
- Djavan B, Dianat SS, Kazzazi A. Effect of combination treatment on patient-related outcome measures in benign prostatic hyperplasia: clinical utility of dutasteride and tamsulosin. Patient Relat Outcome Meas. 2, 71-79, 2011.
- Ismaila A, Walker A, Sayani A, et al. Cost-effectiveness of dutasteride-tamsulosin combination therapy for the treatment of symptomatic benign prostatic hyperplasia: A Canadian model based on the CombAT trial. Can Urol Assoc J. 7(5-6), 393-01, 2013.
- Muller RL, Gerber L, Moreira DM, Andriole G Jr, Hamilton RJ, et al. Obesity is associated with increased prostate growth and attenuated prostate volume reduction by dutasteride. Eur Urol. 63(6), 1115-21, 2013.
- Toren P, Margel D, Kulkarni G, Finelli A, Zlotta A, Fleshner N. Effect of dutasteride on clinical progression of benign prostatic hyperplasia in asymptomatic men with enlarged prostate: a post hoc analysis of the REDUCE study. BMJ. 346, f2109, 2013.
- Wada N, Kita M, Hashizume K, Matsumoto S, Kakizaki H. Urodynamic effects of dutasteride add-on therapy to alpha-adrenergic antagonist for patients with benign prostatic enlargement: Prospective pressure-flow study. Neurourol Urodyn. 2013.
- Wu C, Kapoor A. Dutasteride for the treatment of benign prostatic hyperplasia. Expert Opin Pharmacother. 14(10), 1399-08, 2013.
- Shin, Y. S., Lee, J. W., Kim, M. K., Jeong, Y. B., & Park, S. C. Early dutasteride monotherapy in men with detectable serum prostate-specific antigen levels following radical prostatectomy: A prospective trial. Investigative and clinical urology. 58(2), 98-02, 2017.
- Kang, H. W., Chae, M. H., Park, S. H., Seo, S. P., Kim, W. T., Kim, Y.-J., … Kim, W.-J. Change in Prostate Specific Antigen Concentration in Men with Prostate Specific Antigen Less than 2.5 ng/ml Taking Low Dose Finasteride or Dutasteride for Male Androgenetic Alopecia. The Journal of Urology. 198(6), 1340-45, 2017.
- Hulin-Curtis, S. L., Petit, D., Figg, W. D., Hsing, A. W., & Reichardt, J. K. Finasteride metabolism and pharmacogenetics: new approaches to personalized prevention of prostate cancer. Future oncology (London, England). 6(12), 1897-13, 2010.
- Jun, J., Kinkade, A., Tung, A., & Tejani, A. M. 5α-Reductase Inhibitors for Treatment of Benign Prostatic Hyperplasia: A Systematic Review and Meta-Analysis. The Canadian journal of hospital pharmacy. 70(2), 113-19, 2017.


