Inflamação aguda
A inflamação faz parte do mecanismo de defesa do organismo e desempenha um papel fundamental no processo de cura.
Isso significa que, até um certo ponto, a inflamação é desejável.
Ela pode ser definida como uma resposta do hospedeiro à infecção ou lesão tecidual que ocorre para erradicar patógenos ou agentes irritantes e para potenciar a reparação tecidual. Um agente irritante, pode ser, por exemplo, um espinho. Os patógenos incluem bactérias, vírus e outros organismos que causam infecções.
A inflamação aguda gera sinais claros de que ela está ali, presente.
São 5 sinais, no total, denominado SINAIS CARDINAIS DA INFLAMAÇÃO:
- Dor: pode ocorrer continuamente ou apenas quando uma pessoa toca a área afetada.
- Rubor (ou vermelhidão): isso ocorre devido a um aumento no suprimento de sangue para os capilares na área afetada.
- Perda de função: pode haver dificuldade para mover uma articulação, respirar, sentir o cheiro e assim por diante.
- Tumor (ou inchaço): devido ao acúmulo de líquido (edem) na área afetada.
- Calor: o aumento do fluxo sanguíneo pode deixar a área afetada quente ao toque
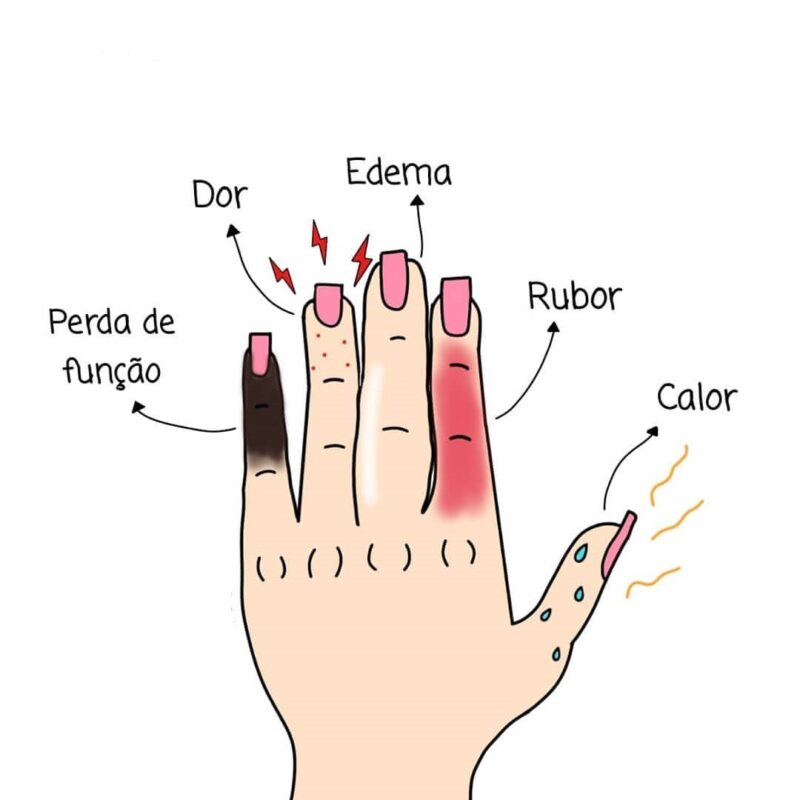
Figura 1 – Sinais cardinais da inflamação
O processo inflamatório é orquestrado por uma série de moléculas, produzidas pelas células do próprio sistema imunológico ou das células endoteliais (aquelas que recobrem a parede interna dos vasos sanguíneos), denominadas citocinas.
Essas citocinas possuem inúmeras funções no processo inflamatório, sendo a principal delas a ativação das células de defesa.
Podemos classificá-las em pró-inflamatórias (estimulam a inflamação) ou anti-inflamatórias (inibem a inflamação).
A predominância de um tipo de citocina em relação ao outro é o que vai determinar o fim da processo inflamatório ou a sua continuidade.
A detecção da inflamação aguda pode ser feita não apenas pela clínica do paciente, mas também por meio de exames laboratoriais. Vários biomarcadores podem ser usados para essa finalidade, dentre os quais se destaca a PCR (Proteína C Reativa).
Os sintomas da inflamação aguda duram alguns dias, apenas.
(Abbas et al., 2019; Croci, et al., 2021)
Inflamação crônica subclínica
A inflamação crônica suclínica, como o próprio nome sugere, não manifesta os sinais clínicos típicos da inflamação: rubor, calor, tumor, dor e perda de função. É uma condição silenciosa que pode passar desaparcebida por anos. Isso significa que o paciente pode ficar longos períodos sem se dar conta de estar nessa condição.
Quando ativada de forma excessiva ou persistente, a inflamação pode causar o comprometimento de órgãos e sistemas, levando à descompensação, disfunção orgânica ou morte.
As causas da inflamação crônica subclínica nem sempre são fáceis de identificar. Mas, há um consenso na literatura científica, de alguns fatores podem iniciar o processo. Listamos abaixo alguns deles:
- Alimentação rica em gorduras saturadas e carboidratos e pobre em fibras;
- Alto consumo de alimentos ricos em glúten;
- Ingestão de alimentos com resíduos de agrotóxicos;
- Ingestão de alimentos com corantes, saborizantes e adoçantes artificiais;
- Excesso de medicamentos, principalmente de antibióticos;
- Excesso de alimentos com atividade pró inflamatória (biscoitos, embutidos, frituras de um modo geral, alimentos industrializados de uma forma geral, dentre outros)
A persistência de um ambiente intestinal inflamado promove alterações no equilíbrio da microbiota intestinal levando ao quadro de disbiose que, por sua vez, promove dimimuição na síntese de mucina e alterações nas tigh junctions. A integridade da barreira intestinal é comprometida como consequência, o que pode levar ao quadro de “leaky gut“, ou seja, a Síndrome do Intestino Permeável, como ilustrado na Figura 2.

Figura 2 – Síndrome do Intestino Permeável
Esta condição é grave, uma vez que o intestino perde a capacidade de selecionar as substâncias que o permeiam e, assim, microrganismos ou parte deles (lipopolissacarídeos de bactérias Gram negativo, principalmente), atravessam o epitélio e caem na corrente sanguínea, levando ao quadro de endotoxemia metabólica. A endotoxemia metabólica é fator de risco para o desenvolvimento de uma série de doenças, as quais serão listadas a seguir:
- asma
- artrite reumatoide
- periodontite
- colite ulcerativa e doença de Crohn
- doença de Alzheimer
- depressão
- síndrome metabólica
- diabetes
- obesidade
Fatores que podem aumentar o risco de inflamação crônica subclínica:
- idade
- obesidade
- uma dieta rica em gorduras e carboidratos
- tabagismo
- baixos hormônios sexuais
- estresse
- problemas de sono
(Yucel-Lindberg & Bage, 2013; Abbas et al., 2019)
Como tratar a inflamação aguda?
O tratamento da inflamação aguda é feito com o uso de anti-inflamatórios não esteroidais (AINES) e esteroidais (AIES), também chamados de corticóides. Abaixo, listamos alguns exemplos:
AINES
- Ácido acetilsalicílico
- Diclofenaco sódico ou potássico
- Nimesulida
- Piroxicam
- Meloxicam
- Cetoprofeno
AIES
- Hidrocortisona
- Prednisona
- Prednisolona
- Dexametasona
- Betametasona
Os AINES e AIES, quando bem indicados, são medicamentos eficazes no tratamento da inflamação aguda. No entanto, para o tratamento da inflamação crônica subclínica, não são os mais indicados, visto que, se usados cronicamente, podem apresentar efeitos colaterais graves. É importante destacar que o uso de anti-inflamatórios deve ser feito com acompanhando médico.
(Goodman & Gilman, 2012)
Como tratar a inflamação crônica subclínica?
A inflamação crônica subclínica pode ser reduzida por meio do uso de probióticos e fitoterápicos com muita eficácia e com baixo potencial de efeitos colataterais.
Probióticos para o tratamento da inflamação crônica subclínica
A modulação da resposta inflamatória ocorre devido as interações entre microrganismos e células do sistema imunológico, após o reconhecimento dos PAMPs (expresso pelos microrganismos) e pelos receptores de reconhecimento de padrão (representados por receptores tipo toll – TLR).
A microbiota intestinal desempenha um papel central na modulação da resposta inflamatória. A Fig. 3 resume os principais mecanismos através dos quais os probióticos modulam a inflamação.

Figura 3 – Imunomodulação dos probiótico Azad et al., 2018
A progressão do processo inflamatório é dependente do balanço entre as citocinas pró (TNF-α, IL-1β, IL-2, IL-6, Il-12, entre outras) e anti-inflamatórias (IL-4, IL-10, TGF-β, entre outras) que são produzidas pelas células envolvidas e que vai determinar na continuidade ou término da inflamação.
(Casas-Solís et al., 2020; Mahooti et al., 2020)
A utlização de probióticos para o tratamento das doenças inflamatórias tem como base a regulação da produção de citocinas pró ou anti-inflamatórias. Um mecanismo de regulação imunológica, envolvendo duas categorias distintas de probióticos (imunoestimuladores e imunorreguladores), é mostrada na Fig. 4.

Figura 4 – Mecanismos de regulação imune dos probióticos
Probióticos imunoestimuladores têm a capacidade para agir contra infecções e células cancerígenas, induzindo o aumento da produção de IL-12 que ativa as células NK que, por sua vez, estimulam o desenvolvimento de células Th1.
Probióticos que aumentam as respostas Th1 podem ser utilizados no tratamento contra infecções causadas por patógenos intra-celulares, câncer e alergia, por meio da promoção de um equilíbrio entre as respostas Th1 e Th2.
Por outro lado, probióticos imunorreguladores são caracterizados por promoverem o aumento de IL-10 e células Treg, o que resulta em diminuição da alergia, doenças inflamatórias intestinais e doenças autoimunes.
Os probióticos imunorreguladores podem ser utilizados para a diminuição da inflamação crônica subclínica.
(Azad et al., 2018)
A seguir, uma lista com os probióticos mais estudados para a redução da inflamação crônica subclínica e aumento da síntese de mucina, o que contribui para a diminuição da permeabilidade intestinal:
- Akkermansia muciniphila
- Lactobacillus rhamnosus
- Lactobacillus gasseri
- Lactobacillus bulgaricus
- Lactobacillus reuteri
- Bifidobacterium spp.
No próximo post, falaremos sobre os Fitoterápicos que podem ser usados em combinação com os probióticos ou de forma isolada para reduzir a inflamação crônica subclínica.
Quer ter acesso a sugestões de fórmulas com probióticos para redução da inflamação crônica subclínica?
Quer ter acesso a mais conteúdo científico?
Acesse sua área restrita no site com seu login e senha.
Não está cadastrado? Cadastre-se clicando no link https://inovacao.farmaciaartesanal.com/registrar/
Referências
Abbas, A.K.; Lichtman, A.H.; Pillai, S. Imunologia Celular e Molecular. 9ᵃ Edição. Elsevier, 2019.
Azad, Abul Kalam., Manobendro Sarker., Dan Wan. Immunomodulatory Effects of Probiotics on Cytokine Profiles. BioMed Research International, 2018.
Casas-Solís, Josefina., María del Rosario Huizar-López., Cesar Antonio Irecta-Nájera., María Luisa Pita-López., Anne Santerre. Immunomodulatory Effect of Lactobacillus casei in a Murine Model of Colon Carcinogenesis. Probiotics and Antimicrobial Proteins vol 12, pages1012–1024, 2020.
Croci, Sonia., Lina Ilaras D’Apolito., Valeria Gasperi., Maria Valeria Catani., Isabella Savini. Dietary Strategies for Management of Metabolic Syndrome:Role of Gut Microbiota Metabolites. Nutrients, 2021.
Goodman & Gilman: As Bases Farmacológicas da Terapêutica. 12ª ed. Rio de Janeiro: McGraw-Hill, 2012
Mahooti M, Miri SM, Abdolalipour E, Ghaemi A. The immunomodulatory effects of probiotics on respiratory viral infections: A hint for COVID-19 treatment? Microb Pathog. 2020 Nov;148:104452.
Yucel-Lindberg, T., & Bage, T. (2013). Inflammatory mediators in the pathogenesis of periodontitis. Expert Reviews in Molecular Medicine, 15.


