A Rosácea é uma desordem de tecido cutâneo crônica, que afeta principalmente a área facial central, incluindo as bochechas, nariz, olhos, queixo e testa
A Rosácea
As manifestações clinicas da Rosácea se dão por características como pele sensível, rubor, eritema persistente, pápulas e pústulas. Embora os sintomas possam aumentar e diminuir em curto prazo, o quadro de rosácea é lentamente progressivo (POWELL, 2005). A Brimonidina apresenta grande eficácia no tratamento da Rosácea.
(CRAWFORD et al., 2004)
A patofisiologia da Rosácea é multifatorial e ainda é pouco compreendida. possivelmente diversos mecanismos relacionam-se com essa doença (ROSSO, 2006).
Muitos fatores intrínsecos e extrínsecos podem desencadear ou agravar a Rosácea e a diminuição da exposição a estes agentes pode contribuir com o tratamento.
(GOLDGAR et al., 2009)
Estes fatores podem ser:
- Clima;
- Vasculaturização;
- Degeneração da matriz dérmica;
- Distúrbios gastrointestinais;
- Exposição tópica e ingestão de agentes químicos;
- Dnormalidades da unidade pilossebácea, susceptibilidade genética às interações com organismos microbianos e resposta imune inata alterada (ARONI et al., 2011; GUPTA & CHAUDHRY, 2005);
- Exposição solar;
- Stress;
- Choque térmico.
A rosácea pode causar danos psicossociais como constrangimento, ansiedade e baixa autoestima, afetando negativamente a qualidade de vida.
(TAN & BERG, 2013)
A progressão de um subtipo para outro é possível e a identificação adequada dos subtipos pode ajudar a orientar estratégias terapêuticas. A rosácea afeta cerca de 10% da população com início normalmente entre 30 e 50 anos e é especialmente comum em indivíduos de pele clara. Simultaneamente, a incidência de Rosácea em mulheres é 3 vezes maior do que nos homens, que por sua vez, são mais propensos a desenvolver a Rosácea Fimatosa.
(CHANG et al., 2014)
Não é comum, mas alguns casos foram diagnosticados em tipos de pele mais escura (GUPTA e CHAUDHRY, 2005). Segundo Fitzpatrick (2008) existem 4 subtipos de Rosácea e os pacientes podem apresentar mais de 1 subtipo:
- Rosácea eritemato-telangiectásica;
- Rosácea pápulo-pustular;
- Rosácea fimatosa;
- Rosácea eritemato-telangiectásica;
- Rosácea ocular.
Rosácea eritemato-telangiectásica
A rosácea eritemato-telangiectásica é descrito como a mais difícil de tratar. As características clínicas deste subtipo incluem rubor e eritema facial central persistente e ou telangiectasia (HUYNH, 2013). 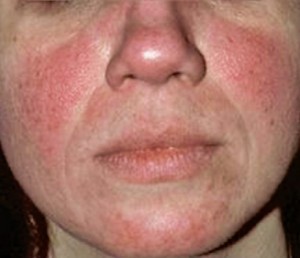
Rosácea pápulo-pustular
A rosácea pápulo-pustular é semelhante a acne vulgar. As características clínicas deste subtipo incluem eritema facial central persistente e pápulas e pústulas transitórios e edema facial pode estar presente (HUYNH, 2013). 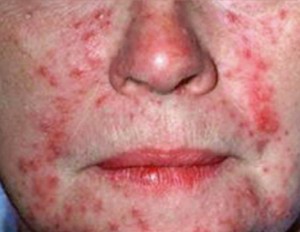
Rosácea fimatosa
A rosácea fimatosa é mais comum nos homens, se caracteriza por hipertrofia e espessamento da pele, tornando-a irregular, especialmente do nariz
(CHANG et al., 2014)
(MOUSTAFA et al., 2014).
Rosácea ocular
Os sinais e sintomas da rosácea ocular são estimados a afetar cerca de 60% dos pacientes com rosácea. As características clínicas deste subtipo incluem lacrimejamento ou vermelhidão na região dos olhos, telangiectasia ao redor da conjuntiva e eritema periocular.
As apresentações clínicas comuns deste subtipo incluem blefarite, conjuntivite, ceratite e alguns pacientes relatam um desconforto ocular, incluindo sensação de corpo estranho, sensibilidade à luz e visão turva.
(HUYNH, 2013)
 Benefícios da utilização de bromonidina
Benefícios da utilização de bromonidina
- Menor desconforto com a aparência;
- Melhor aparência do tecido cutâneo;
- Inibição de mediadores inflamatórios;
- Reduz eritema;
- Percepção de melhora rápida após aplicação.
Possíveis mecanismos de ação
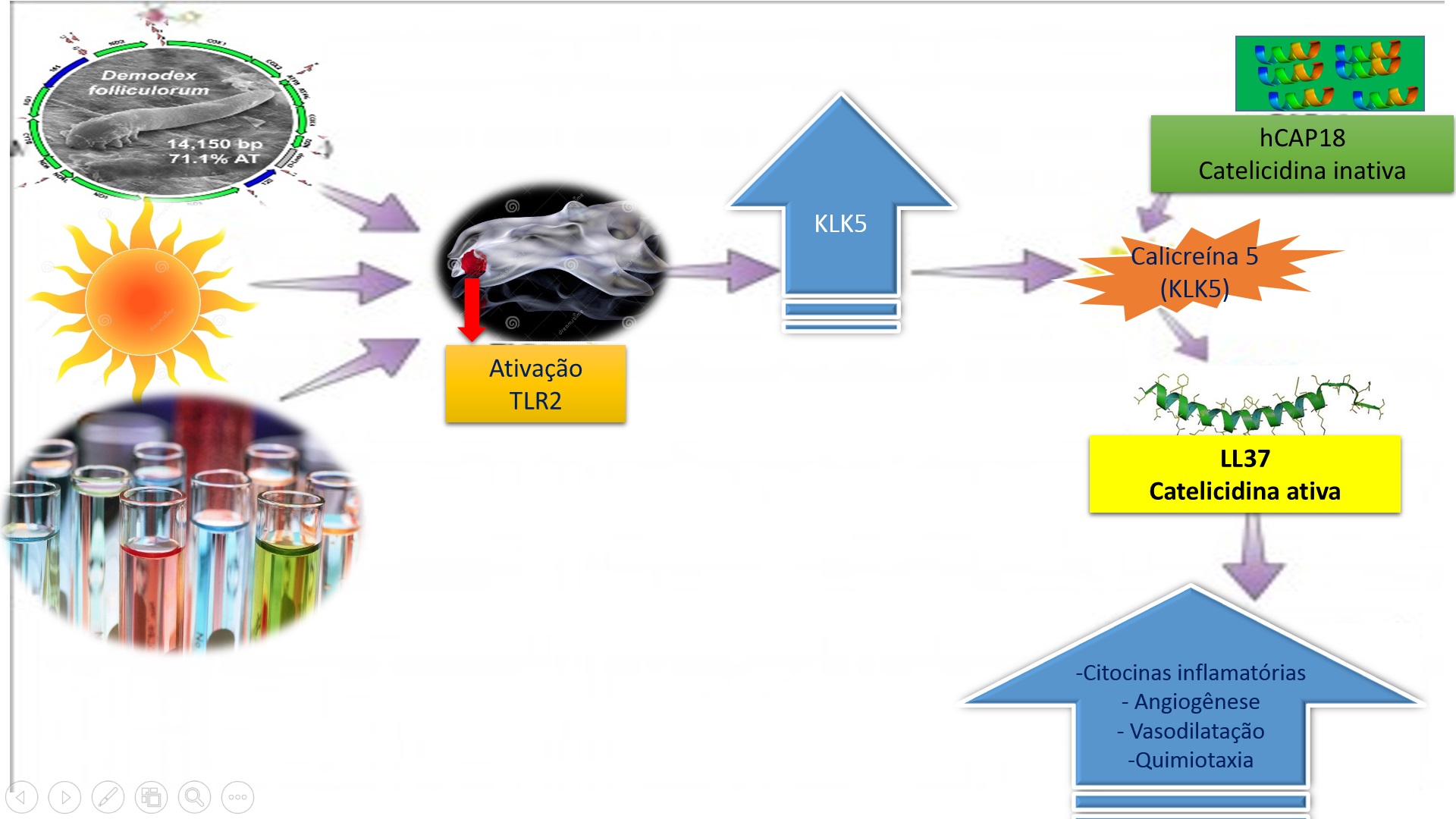
- Impacto da desregulação do sistema imune inato na rosácea
A desregulação do sistema imune inato pode contribuir com alterações cutâneas, como inflamação e anormalidade na vascularização crônica em pacientes com rosácea. Um mecanismo possivelmente relevante envolve a ativação do receptor Toll2 (TLR2).
A princípio, inúmeros estímulos ambientais podem ativar os TLR2, como o trauma físico ou químico, a luz UV, e microorganismos. Isto resulta na libertação de uma enzima de processamento, a calicreína 5 (KLK5), a partir de queratinócitos da epiderme.
Do mesmo modo, esta enzima é responsável pelo processamento do peptídeo antimicrobiano catelicidina que transforma a forma inativa em ativa, LL-37. Na pele propensa a rosácea, possui as formas de peptídeos catelicidina proteoliticamente transformados, que são diferentes em indivíduos não acometidos pela doença e são mais pró-inflamatórios (MOUSTAFA et al., 2014).
Ainda assim, não é claro como a forma anormal de catelicidina é desenvolvida, mas existe a hipótese de ser o resultado de anormalidades de processamento pós-tradução associados com um aumento na KLK5, também conhecida como enzima tríptica do estrato córneo (SCTE), na epiderme.
Por outro lado, existe maior expressão de TLR2 em queratinócitos de pele rosácea e aumento dos níveis de catelicidina e KLK5 presente na pele de pacientes com rosácea. Dessa forma, hipotetizando com relevância seu papel na patogênese da rosácea, devido ao aumento da liberação de citocinas inflamatórias e angiogênese.
Estudos em ratos com a injeção de péptidos catelicidina de pacientes com rosácea levou a inflamação e dilatação vascular, apoiando ainda mais a função de catelicidina na patogênese da rosácea (MOUSTAFA et al., 2014).
Impacto da desregulação do sistema vascular e neurovascular na rosácea
A princípio, o Eritema facial é um componente central da rosácea e é necessário avaliar o tipo de Eritema para o correto diagnóstico. O agravamento da doença está associado com a persistência e intensidade do eritema facial.
O fluxo sanguíneo da pele é aumentado em alguns pacientes, evidenciando o papel da desregulação vascular na patogênese da rosácea. Sendo assim, pode ser um fator importante para promover a alteração cutânea com presença de eritema facial em pacientes com rosácea, podendo ser facial central ou eritema perilesional (circundante pápulas e pústulas) (MOUSTAFA et al., 2014).
A desregulação neurovascular, ou vasodilatação aumentada, possivelmente desempenha um papel importante. O sistema cutâneo superficial é amplamente regulado pelo sistema nervoso simpático, através da ação sobre os adrenoreceptores.
Embora o seu papel na patofisiologia da Rosácea ser pouco compreendido, sua atuação é evidenciada pela capacidade de atuarem no tratamento para reduzir o eritema presente na Rosácea (MOUSTAFA et al., 2014).
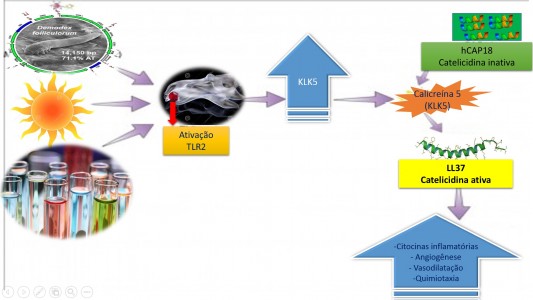
(MOUSTAFA et al., 2014)
O crescimento excessivo de organismos comensais
Demodex é um ácaro parasita pequeno que normalmente é encontrado no folículo piloso e que parece servir de gatilho patogênico para o aparecimento da rosácea. Pacientes com manifestação desta condição possuem números significativamente maiores de ácaros demodex (Demodex folliculorum e Demodex brevis) em comparação pacientes saudáveis (SATTLER et al., 2015).
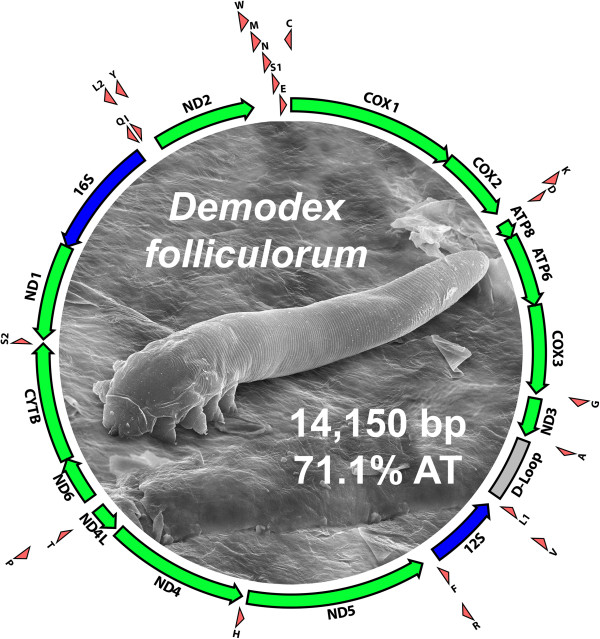
Fonte: Palopoli et al., 2014
Proteínas produzidas por uma bactéria (Bacillus oleronius) isolada a partir do ácaro Demodex podem desencadear e agravar as respostas inflamatórias nas manifestações de rosácea.
(MAIBACH, 1991; MCMAHON et al., 2014)
Segundo Jarmuda e colaboradores (2014) as proteínas do bacillus oleronius foram encontradas em 82,6% (62/75) dos pacientes com rosácea e em 26,9% (14/52) do grupo controle (sem rosácea). Satttler e colaboradores (2015) realizaram um estudo em 25 pacientes, após quantificar o número de demodex por folículo antes e depois do tratamento da rosácea. Constaram que com a melhora clínica da rosácea, houve redução em torno de 39% da população do ácaro demodex.
O tratamento da rosácea com retinóides sistêmicos inibiu a produção de sebo e consequentemente reduziu o número de ácaros (HUYNH, 2013).
Ativos utilizados no tratamento da rosácea
- Brimonidina;
- Ácido azelaico;
- Metronidazol;
- Ivermectina;
- Sufacetamida;
- Doxicilina (via oral).
Brimonidina
A brimonidina é um agonista do receptor alfa-2 adrenérgico. Tem sua utilização conhecida por seu uso em colírios para reduzir a pressão intraocular em hipertensão. Além disso, possui ação na redução do eritema facial através da vasoconstrição.
(JACKSON et al., 2014)
Aprovado pelo FDA e pela Health Canada, a Brimonidina tópica em gel a 0,33% é indicada para eritema persistente da Rosácea. A aprovação foi baseada na eficácia clínica e na segurança comprovada nos ensaios clínicos em larga escala.
Em suma, esse é o primeiro tratamento aprovado para o tratamento tópico do eritema persistente causado pela Rosácea. Vermelhidão facial é extremamente comum em pacientes com Rosácea, afetando até 87% dos doentes portadores dessa doença.
(CHANG et al., 2014; TANGHETT et al., 2015)
Estudos demonstram que pacientes usando gel de 0,5% de Brimonidina apresentaram melhora clínica notável. Observa-se melhora significativa 30 minutos após a aplicação, embora o resultado maior é observado entre 3 a 6 horas após aplicação.
Os efeitos adversos podem ocorrer, mas em sua maioria são transitórios e leves. Sendo assim, o efeito mais relatado é o agravamento do eritema (5,1%), prurido (5,0%), irritação da pele (1,2%) e piora da rosácea (1,1%). Além disso, os dados recentemente publicados a partir de 12 meses de uso, a eficácia sustentada sem incidência de taquifilaxia no tratamento a longo prazo.
(CHANG et al., 2014)
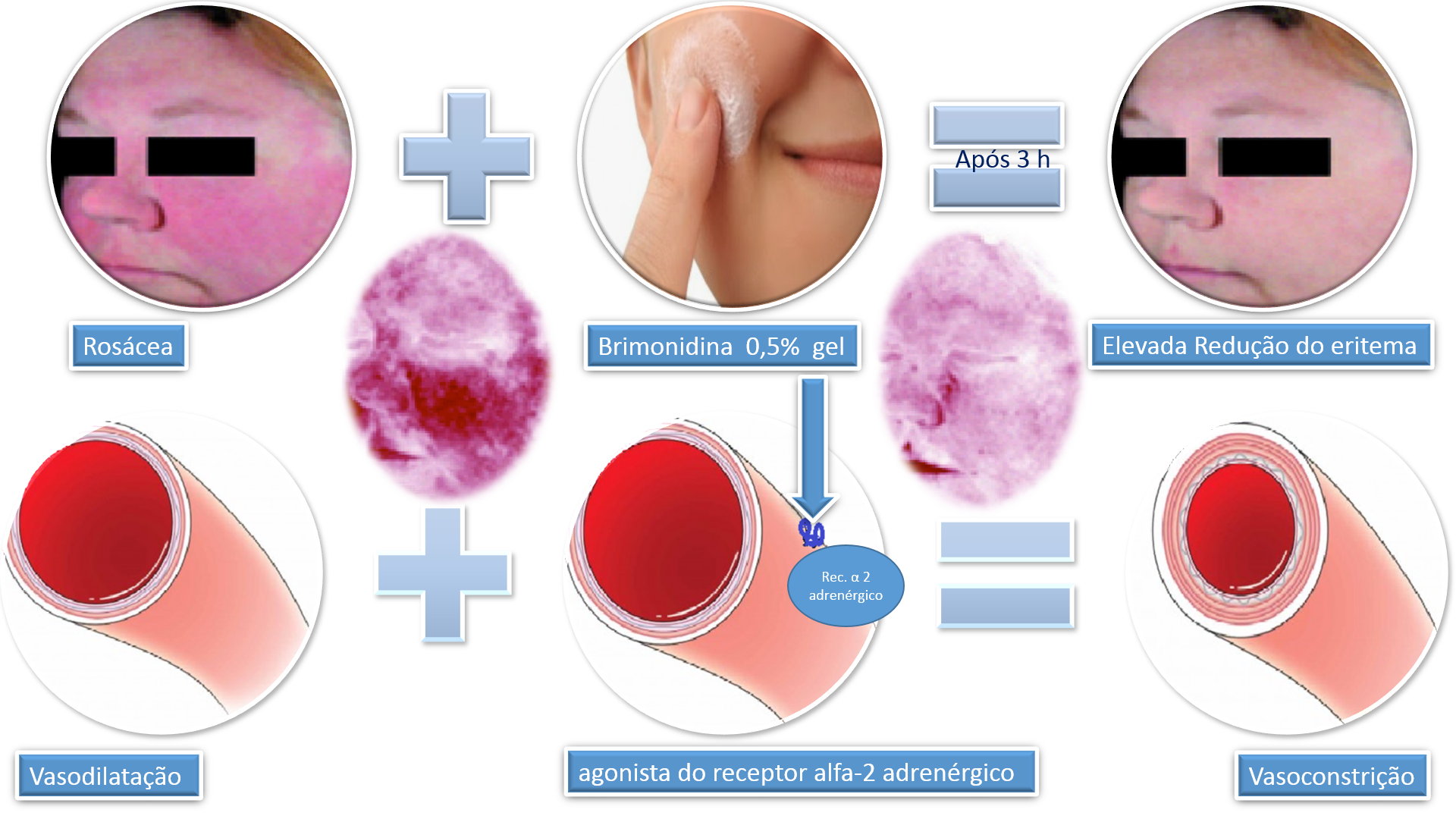
Fonte: Adaptado de Fowler et al., 2013
Ácido azelaico
Gel de ácido azeláico 15% é indicado para o tratamento tópico das pápulas inflamatórias e pústulas de rosácea. O mecanismo de ação é também desconhecido. Vários estudos indicaram que o ácido azelaico pode exercer efeitos anti-inflamatórios em pacientes com Rosácea.
Os eventos adversos relatados em um estudo clínico de 15 semanas de gel azelaico incluem ardência, formigamento, ressecamento, descamação, coceira, eritema, irritação e vermelhidão.
(HUYNH, 2013)
Sulfacetamida
Sulfacetamida de sódio tópica de 10% com 5% de enxofre tem sido utilizado há mais de 50 anos para a sua eficácia clínica e segurança no tratamento de rosácea, embora o seu mecanismo de ação ainda não é bem compreendido.
Em um estudo de 8 semanas com sulfacetamida de 10% associado a 5% de enxofre tem sido mostrado para redução das lesões inflamatórias (78% versus 36% placebo) e eritema facial (83% versus 31% placebo).
(SAUDER et al., 1997)
Ivermectina (IVM)
Um total de 962 pacientes foram distribuídos aleatoriamente para receber IVM 1% (478) ou metazolina (MTZ) 0,75% (484). Na semana 16 (IVM 1%) foi significativamente superior à (MTZ 0,75%) na redução das lesões inflamatórias (83%). A incidência de eventos adversos foi comparável entre os grupos e a tolerância local foi melhor para IVM 1%.
(TAIEB et al., 2015)
O uso de ivermectina oral e tópica têm sido estudados para o tratamento da Rosácea papulo-pustular, ambos mostrando benefício. No entanto, só o uso de ivermectina a 1% em creme foi estudado em ensaios clínicos randomizados.
(MOUSTAFA et al., 2014)
A Ivermectina possui ação antimicrobiana, antiparasitário e anti-inflamatória.
(ABOKWIDIR & FLEISCHER, 2015)
Doxiciclina (uso oral)
Dose sub-antimicrobiana de doxiciclina é a melhor opção terapêutica oral apoiada em pesquisa. Pode ser usada para tratar formas moderadas a graves de rosácea papulo-pustular ou ocular, ou em pacientes que podem ser mais aderente em um tratamento sistêmico.
(CHANG et al., 2014)
As propriedades anti-inflamatórias das tetraciclinas, em vez das suas propriedades antibacterianas, são a razão principal para a sua utilização no tratamento da rosácea. Vale ressaltar que, em um estudo de comparação doxiciclina 40 e 100 mg/dia foram igualmente eficazes, com o regime de baixa dose com poucos efeitos adversos, especialmente sintomas gastrointestinais.
(DEL ROSSO, 2008)
Doxiciclina 40 mg fornece atividade anti-inflamatória a uma dose subantimicrobiana com um risco reduzido de resistência bacteriana em comparação com doses mais elevadas de doxiciclina.
Estudos demonstraram que a administração da doxiciclina (40 mg) uma vez por dia durante 9 meses não levou o desenvolvimento da resistência aos antibióticos em pacientes com doença periodontal. As reações adversas mais comuns relatados nos ensaios clínicos são nasofaringite, sinusite, diarreia, hipertensão.
(HUYNH, 2013)
Referências
Cline A, Uwakwe L N, McMichael A J. (2018). No Sulfates, No Parabens, and the “No-Poo” Method: A New Patient Perspective on Common Shampoo Ingredients. Skin of color: Cutis, 101(1), 23-26.
Chuang A H, Bordlemay J, Goodin J L, Pherson J C. Effect of Sodium Lauryl Sulfate (SLS) on Primary Human Gingival Fibroblasts in an In Vitro Wound Healing Model, Military Medicine. 184(1), 97–01, 2019.
Gavazzoni Dias MF, de Almeida AM, Cecato PM, Adriano AR, Pichler J. The Shampoo pH can Affect the Hair: Myth or Reality?. Int J Trichology. 6(3), 95-9, 2014.
Bhatti HA, Basra MK, Patel GK.Hair restoration approaches for early onset male androgenetic alopecia. J Cosmet Dermatol. 12(3), 223-31, 2013.
Birch MP, Messenger JF, Messenger AG. Hair density, hair diameter and the prevalence of female pattern hair loss. Br J Dermatol.144:297-04, 2001.
Beltadze K, Barbakadze L. Diagnostic features of polycystic ovary syndrome in adolescents (review). Georgian Med News. 238, 32-4, 2015.
Price VH. Androgenetic alopecia in adolescents. Cutis. 71, 115-21, 2003.
Boersma IH, Oranje AP, Grimalt R, Iorizzo M, Piraccini BM, Verdonschot EH1 .The effectiveness of finasteride and dutasteride used for 3 years in women with androgenetic alopecia. Indian J Dermatol Venereol Leprol. 80(6), 521-25, 2014.
Blume-Peytavi U, Blumeyer A, Tosti A, Finner A, Marmol V, Trakatelli M, et al. S1 guideline for diagnostic evaluation in androgenetic alopecia in men, women and adolescents. Br J Dermatol. 164, 5-15, 2011.
Cash TF, Price VH, Savin RC. Psychological effects of androgenetic alopecia on women: Comparisons with balding men and with female control subjects. J Am Acad Dermatol. 29, 568-75, 1993.
Clark RV, Hermann DJ, Cunningham GR, et al. Marked suppression of dihydrotestosterone in men with benign prostatic hyperplasia by dutasteride, a dual 5alpha-reductase inhibitor. J Clin Endocrinol Metab 89, 2179-84, 2004.
Eun HC, Kwon OS, Yeon JH, Shin HS, Kim BY, Ro BI, et al. Efficacy, safety, and tolerability of dutasteride 0.5 mg once daily in male patients with male pattern hair loss: A randomized, double-blind, placebo-controlled phase III study. J Am Acad Dermatol. 63, 252-58, 2010.
Ghanizadeh, Ahmad and Ayoobzadehshirazi, Anaheed. A Review of Psychiatric Disorders Comorbidities in Patients with Alopecia Areata. Int J Trichology. 6(1), 2–4, 2014.
Gubelin HW, Martínez JB, Tsai T-F, Katsuoka, K. Kawashima M. Tsuboi R. Barnes A. Ferron-Brady G C. A randomized, active- and placebo-controlled study of the efficacy and safety of different doses of dutasteride versus placebo and finasteride in the treatment of male subjects with androgenetic alopecia. J Dermatolog Treat. 25(2), 156-61, 2014.
Jung JY, Yeon JH, Choi JW, Kwon SH, Kim BJ, Youn SW, Park KC, Huh CH. Effect of dutasteride 0.5 mg/d in men with androgenetic alopecia recalcitrant to finasteride. Int J Dermatol. 53(11), 1351-57, 2014.
Kaufman KD, Olsen EA, Whiting D, Savin R, DeVillez R, Bergfeld W, Price VH, Van Neste D, Roberts JL, Hordinsky M, Shapiro J, Binkowitz B, Gormley GJ. Finasteride in the treatment of men with androgenetic alopecia. Finasteride Male Pattern Hair Loss Study Group. J Am Acad Dermatol. 39(1), 578-89, 1998.
Olsen EA, Hordinsky M, Whiting D, Stough D, Hobbs S, Ellis ML, et al. The importance of dual 5alpha-reductase inhibition in the treatment of male pattern hair loss: Results of a randomized placebo-controlled study of dutasteride versus finasteride. J Am Acad Dermatol. 55, 1014-23, 2006.
Vano-Galván S, Molina R-AM, Serrano-Falcón C, Arias-Santiago S, Rodrigues Barata-AR, Garnacho-Saucedo G, Martorell-Calatayud A, Fernández-Crehuet P, Grimalt R, Aranegui B, Grillo E, Diaz-Ley B, Salido R, Pérez-Gala S, Serrano S, Moreno JC, Jaén P, Camacho FM. Frontal fibrosing alopecia: a multicenter review of 355 patients. J Am Acad Dermatol. 70(4), 670-78, 2014.
Yim, Elizabeth; Nole, Katherine L. Baquerizo; Tosti, Antonella. 5α-Reductase inhibitors in androgenetic alopecia. Curr Opin Endocrinol Diabetes Obes. 21(6), 493-98, 2014.



