Existe uma demanda crescente para ajudar no tratamento das desordens inflamatórias com a utilização de anti-inflamatórios naturais
O uso de fitoterápicos tem sido recorrente, e existe uma demanda crescente para ajudar no tratamento das desordens inflamatórias com a utilização de anti-inflamatórios naturais. Existe um grande arsenal terapêutico com diversas espécies e estudos evidenciados, que são disponibilizados em menor custo e com menos efeitos adversos.
A sua ação imunoestimuladora sobre os mediadores inflamatórios se dá por efeitos anti-inflamatórios dos diferentes compostos com mecanismos relacionado a interleucinas (ILs), fator nuclear kappa B (NF-κB), prostaglandina E2 (PGE2), ciclooxigenase (COX) e espécies reativas de oxigênio (ROS.
(RIBEIRO et al., 2018; GHASHEMIA et al., 2016)
Os compostos presentes com ação anti-inflamatória estão ligados a flavonóides, polifenólicos, proantocianidinas, alcalóides, terpenóides e esteroides. Sendo assim, são responsáveis pelas atividades anti-inflamatórias dos extratos vegetais. Esses metabólitos secundários atuam em diferentes alvos envolvidos na via inflamatória.
(RIBEIRO et al., 2018; GHASHEMIA et al., 2016)
Os flavonoides estão envolvidos com a resposta inflamatória por meio de seus efeitos antioxidantes, sequestrando os radicais livres que se dão através de espécies reativas ao oxigênio e na quelação de ions metálicos.
Os radicais livres estão ligados à produção de energia, regulação do crescimento celular e sinalização intercelular. Porém, ocorrendo desequilíbrio entre a geração de radicais livres e os mecanismos de defesa do organismo, a quantidade aumentada de radicais livres pode gerar lipídios que por sua vez vão gerar certa agressão nas membranas celulares, proteínas nos tecidos, enzimas e DNA. E, dessa forma, induzindo oxidações, levando a danos à membrana, modificações de proteínas e danos no DNA.
(RIBEIRO et al., 2018)
A atividade anti-inflamatória dos terpenoides está ligada aos triterpenos diterpenos por causa da sua capacidade de inibir a síntese de prostraglandina E2 (PGE2) e óxido nítrico (NO), inibindo ainda IL-2, IFN-g e TNF-α. Os sesquiterpenos estão ligados a inibição da mediadores inflamatórios IL-1 e TNF-α.
(RIBEIRO et al., 2018)
Os alcaloides com propriedades anti-inflamatórias impede a liberação de PGE2 (RIBEIRO et al., 2018). É característico do processo inflamatório dor, rubor (vermelhidão), tumor (inchaço), febre e calor (calor). Os mecanismos moleculares responsáveis pelo desenvolvimento destes sintomas são agora entendidos como resultado de uma maior expressão de um subconjunto de genes que normalmente mantêm a homeostasia fisiológica.
Inúmeras doenças são causadas ou agravadas pela inflamação. Muitos pesquisadores buscam pelos benefícios dos anti-inflamatórios naturais para tentar controlar a inflamação crônica com o mínimo de efeitos adversos.

Mediadores solúveis, tais como o óxido nítrico (NO), prostaglandinas (PGs), fator de necrose tumoral-α (TNF-α) e interleucina-1 (IL-1), geralmente desempenham um papel no controle de funções importantes: a regulação da pressão sanguínea, agregação plaquetária e a temperatura corporal. Sob condições inflamatórias patologicamente, no entanto, a produção destas moléculas promovem eventos desde o aumento na infiltração de leucócitos e na permeabilidade vascular até a falha do órgão.
A inibição seletiva destas e de outras atividades inflamatórias continua a ser um objetivo importante para o tratamento eficaz da inflamação.
(D’ACQUISTO et al., 2002; KARIN & BEM-NERIAH, 2000; GHOSH et al.,1998)
Muitas doenças como Alzheimer, diabetes, doenças cardiovasculares, asma, artrite reumatoide, periodontite, câncer e outras são resultantes de processos inflamatórios inapropriados ou excessivos, que se iniciam e se desenvolvem de forma crônica.
(CHAPKINA et al., 2009)
Assim, os processos e eventos provocados pela inflamação são necessários e fazem parte da homeostasia, possuindo muitos benefícios, mas as reações de inflamação também podem ser excessivas e levar a resultados prejudiciais.
Os mediadores inflamatórios invocam sinais de inflamação incluindo acúmulo de leucócitos e extravasamento de plasma por pequenos vasos do tecido inflamado, entre estes mediadores estão os leucotrienos, que constituem uma família formada a partir do ácido araquidônico
(RADMARK et al., 2015)
Segundo Chapkina e colaboradores (2009) a inflamação é caracterizada por ativação e produção de pelo menos quatro classes de compostos ativos:
- Citocinas inflamatórias;
- Leucotrienos;
- Cicloxigenase;
- Ácido araquidônico;
- Moléculas de adesão;
- Outros mediadores inflamatórios.
Citocinas inflamatórias
Citocinas são moléculas proteicas, glicosiladas (ligadas a molécula de açúcar) ou não, que são mediadoras de sinais estimulatórios, modulatórios ou mesmo inibitórios para as diferentes células do sistema imunológico.
Têm função autócrina – agindo na própria célula produtora, parácrina – atuando em células próximas e endócrina – quando sua ação se dá à distância. Atuam em concentrações baixíssimas e sua síntese habitualmente ocorre após a estimulação de antígenos.
(CHAPIKIN et al., 2009; DINARELLO, 2000; RIBEIRO et al., 2018)
Até o momento, existem 18 citocinas com o nome de Interleucina (IL), outras mantem sua descrição biológica original, como o Fator de Necrose Tumoral (TNF).
Algumas citocinas promovem a inflamação (citocinas pró-inflamatórias) IL-1, IL-2, IL-6, IL-7, TNF e IFN-γ, já outras podem se apresentar com ação de supressão em processo de inflamação das pró-inflamatórias (citocinas anti-inflamatórias), as IL-4, IL-10 e IL-13 são citocinas anti-inflamatórias devido a sua capacidade de suprimir genes de citocinas pro-inflamatórias como a IL-1, IL-6, TNF e quimiocinas.
(DINARELLO, 2000)
| Mediador inflamatório | Função |
| 5-Lipogênese | Responsável por catalisar a primeira etapa na formação dos leucotrienos, que desempenham um papel essencial em muitas doenças, como a asma e a aterosclerose. |
| Fosfolipase A2 | Enzima fundamental na inflamação, responsável pela liberação do ácido araquidônico a partir dos fosfolípides membranares. |
| Fator de Necrose Tumoral –alfa (TNF-α) | Pode induzir febre, quer diretamente através da estimulação de PGE2 ou indiretamente por indução da libertação de IL-1. TNF-α partilha também uma propriedade inflamatória importante com a IL-6 e IL-11, isto é, a indução da produção de proteínas reagente de fase aguda no fígado. |
| IL-1 | Pode desencadear febre, aumentando a prostaglandina E2, estimular a proliferação de células T, além de induzir a libertação de histamina a partir de mastócitos no local da inflamação. |
| IL-2 | Atua como um ativador para as células T, células natural killer (NK) e células B. Desempenha um papel crítico na regulação tanto de respostas inflamatórias crônicas celulares e humorais. A ligação de IL-2 em linfócitos T leva à proliferação celular, o aumento da secreção de linfoquina, e também a expressão aumentada de moléculas complexo imunohistocompatibilidade (MHC) classe II. |
| IL-6 | Além da estimulação da síntese de proteínas de fase aguda no fígado, a IL-6 atua como um fator de crescimento para as células B maduras e induz maturação final de células produtoras de anticorpos. Foi observada em uma variedade de desordens autoimunes e inflamatórias crónicas, tais como tireoidite, diabetes do tipo I, artrite reumatoide entre outras. |
| IL-8 | Pertence a uma família de citocinas quimiotática e são responsáveis para a migração e a ativação de neutrófilos e de outros tipos de células (tais como monócitos, linfócitos, basófilos e eosinófilos) nos locais de inflamação, assim, a IL-8 medeia o recrutamento e a ativação de neutrófilos no tecido inflamado, podendo ser encontrado no fluido sinovial nos indivíduos acometidos por diversas doenças inflamatórias de origem reumáticas. A superexpressão da mesma é presente em doenças inflamatórias crônicas e também no choque séptico. |
| IL-10 | Redução da proliferação de células T específicas para antígenos, inibição da produção de IFN-γ induzido por células NK, e a inibição de IL-4 e IFN-γ, induz a expressão de MHC de classe II em monócitos. Uma vez que IL-10 pode ser produzida por células TH2 e inibe a função de produção de citoquinas (tais como IFN-gama), a IL-10 é considerado um fator cross-reguladora das células T e, assim, tem sido referida como anticitocina. |
| IL-17 | Produto dos linfócitos T ativados na sua atividades biológica está a estimulação de IL-6 e IL-8. |
Fonte: (FEGHALI & WRIGHT, 1997; CABRERIZO et al., 2013; PALOMINO & MARTI, 2015)
Mecanismo de ação dos anti-inflamatórios naturais
O alvo especifico dos agentes anti-inflamatórios é a inibição de enzimas geradoras de eicosanóides, incluindo fosfolipase A2, ciclooxigenases (COXs) e lipoxigenases, levando à redução de prostanoides e leucotrienos, podendo ainda impedir a liberação de histamina, fosfodiesterase, proteínas quinases e ativação de transcriptases.
(RIBEIRO et al., 2018)
Com a instalação de dano tecidual, a resposta inflamatória é desencadeada pela síntese de TNF-α, este é o mediador primário da inflamação. Quando sua presença é em maior quantidade, é induzida a produção de outras citocinas pró-inflamatórias e do sistema oxidativo.
Dessa forma, há a estimulação sintetize de prostaglandina E2 (PGE2), ativação da coagulação, apoptose celular eativação do fator de transcrição nuclear kappa B (NF-κB). Assim, a liberação de outras citocinas pró-inflamatórias é estimulada, além de quimiocinas e proteases e da produção de IL-1 com função semelhante à do TNF, estimulando a ativação da ciclooxigenase-2 (COX-2) e a produção de óxido nítrico, seguida da produção de IL-6, citocina, responsável por promover a síntese protéica de fase aguda pelos hepatócitos.
(RIBEIRO et al., 2018; GHASHEMIA et al., 2016)
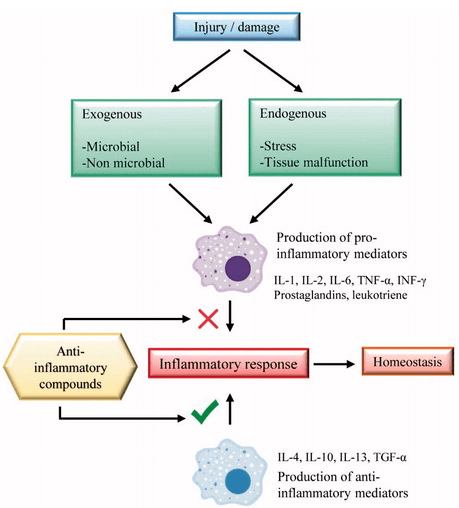
Fonte: (RIBEIRO et al., 2018)
Moléculas envolvidas no processo inflamatório
Os outros mediadores da resposta inflamatória são as várias famílias de mediadores que não se encaixam em uma classe especifica e podem derivar tanto de precursores plasmáticos quanto de células, incluindo produtos de clivagem de precursores, produtos de cascatas de ativação, substâncias pré-formadas, radicais livres de oxigênio e óxido nítrico.
Por exemplo, o fator de ativação plaquetária, histamina, cinina, leucotrienos, ácido araquidônico, moléculas de adesão e Fator Nuclear ĸB (NF-ĸB).
(TIAN et al., 2016)
Cicloxigenase
São enzimas responsáveis pelo desenvolvimento da prostaglandina, as suas isoformas são COX-1, COX-2 e COX-3. São sintetizadas por intermédio do ácido araquidônico, produzido por meio da fosfolipase A2. Os diferentes processos levam a síntese de prostaglandina, tromboxanos e leucotrienos.
(RIBEIRO et al., 2018)
Ácido araquidônico
O ácido araquidônico (AA) é um ácido graxo poli-insaturado essencial do ômega 6, esterificado a fosfolipídios em membranas plasmáticas e nucleares. O ácido araquidônico serve como precursor para os mediadores lipídicos bioativos, chamados de eicosanoides.
E a libertação de AA a partir de fosfolipídios membranares ocorre por estimulação de fatores de crescimento, citocinas ou trauma mecânico. Como exemplo destes eicosanoides temos leucotrienos e prostaglandinas, mediadores importantes envolvidos em numerosos processos homeostáticos e fisiopatológicas.
(YIN et al., 2013; TRIPATHI & ALIZADEH, 2014; GHASHEMIA et al., 2016)
Moléculas de adesão
Moléculas de adesão são uma classe de moléculas presentes na superfície celular ao qual os leucócitos são dependentes para realizar o processo de migração do espaço intravascular para os tecidos (diapedese). As principais famílias dessa classe incluem as selectinas, a superfamília das imunoglobulinas, e as integrinas (INWALD et al., 2001).
Leucotrienos
Existem vários tipos leucotrienos (LT) com funções distintas, por exemplo, os LTB4 são quimiotáticos para diversos leucócitos (como neutrófilos, células dendríticas e células T), enquanto LTC4 conduz o aumento da vasopermeabilidade de capilares venosos. Alguns tipos de leucotrienos também estão implicados na função de células apresentadoras de antígeno (APCs).
(RADMARK et al., 2015)
A enzima 5-lipoxigenase (5LOX) é expressa por vários leucócitos: polimorfonucleares (neutrófilos e eosinófilos), mastócitos, monócitos, macrófagos, células dendríticas e em linfócitos B. Ela é responsável por catalisar a primeira etapa na formação dos leucotrienos, que desempenham um papel crucial em muitas doenças, como a asma e a aterosclerose. A participação desta enzima na via de desenvolvimento de diferentes tipos de câncer, câncer pancreático, coloretal e leucemia.
(HAFNER et al., 2015; RADMARK et al., 2015; GHASHEMIA et al., 2016)
Fator Nuclear ĸB (NF-ĸB)
Fator Nuclear ĸB (NF-ĸB) é uma família de fatores de transcrição envolvidos com diversos genes, muitos destes ligados a resposta imunoinflamatória, outros ligados a apoptose e também a transformação neoplásica celular.
Com relação a resposta inflamatória ele promove a regulação de genes como os das moléculas de adesão de leucócitos, de enzimas, COX-2 e 5-LO e também a maior parte das citocinas, por exemplo, TNF-α, IL-1, IL-2, IL-6, IL-8 e IL-12. Atualmente NF-ĸB vem sendo relatado como um dos principais reguladores da expressão de genes pró-inflamatórios.
(BLANCO & CONDINO NETO, 2003; D’ACQUISTO et al., 2002; KARIN & BEM-NERIAH, 2000; GHOSH et al., 1998; SUN et al., 2013)
Em células não estimuladas, o NF-kB é sequestrado dentro do citoplasma por uma proteína inibidora de NF-kB (IKB) que mascara o sinal de localização nuclear presentes no interior da sequência de proteína de NF-kB. O tratamento das células com as citocinas pró-inflamatórias, tais como TNF-α e IL-1, ou com os produtos bacterianos, tais como lipopolissacáridos (LPS), conduz à ativação de um complexo específico de IkB-cinase (IKK) que fosforila IkB e, consequentemente, o identifica para ubiquitinação e degradação pelo proteassoma. A degradação de IkB permite, a translocação do NF-kB para o núcleo aonde pode atuar como um fator de transcrição.
(BLANCO & CONDINO NETO, 2003; D’ACQUISTO et al., 2002; KARIN & BEM-NERIAH, 2000; GHOSH et al.,1998; SUN et al., 2013).
Cininas
As cininas representa um grupo de peptídeos biologicamente ativos geradas nos locais de danos nos tecidos, em resposta a um trauma ou infecção, ou durante a maioria dos processos inflamatórios. Seus principais efeitos farmacológicos consistem em contração do músculo liso, relaxamento, vasodilatação, aumento da permeabilidade vascular e a sensibilização de fibras nociceptivas.
As cininas exercem a maior parte dos seus efeitos através da estimulação de dois receptores diferentes acoplados a proteína G, classificados como B 1 e B 2.
(Regoli & Barabe, 1980; MEDEIROS et al., 2007)
Fitoterápicos com ação imunomoduladora e anti-inflamatória natural
| Ativos | Descrição | Mediadores inflamatórios Inibidos | Referência |
|---|---|---|---|
| Curcuma longa | Principal constituinte da C. longa é a curcumina. | Vias de sinalização de TLR-4 e de NF-ĸB | NEYRINCK et al., 2013; CHONG et al., 2014; GHASHEMIA et al., 2016 |
| Zingiber officinale | Possui diferentes ações no organismo | Eleva o TNF α e reduz marcadores proinflamatótios. | GHASHEMIA et al., 2016 |
| Boswellia serrata | Principal ativo identificado nesta planta é o ácido boswélico. | 5-lipoxigenase, Reduz liberação de leucotrienos. | SAFAYHI et al., 1992; GRUPTA et al., 1997; GHASHEMIA et al., 2016. |
| Cordia verbenacea | Ação antiflamatória está ligada a a presença de α-humuleno e trans-cariofileno em sua composição. | Fosfolipase A2, TNF α e IL-1. | DE CARVALHO et al., 2004; PASSOS et al., 2007 |
| Ômega 3 | Contém ácidos graxos do ômega-3(EPA e DHA) e mediadores especializados (protectinas, resolvinas e maresinas). | TNF α, IL-1, e IL-6 | MIYATA et al., 2015 |
| Rosmarinus officinale | Potencial antiflamatório devido a presença do ácido rosmarinicus | TNF α, IL-1. Inibe infiltração de neutrófilos e diminui mediadore antiflamatórios. | GHASHEMIA et al., 2016. |
| Uncaria tomentosa (unha de gato) | Imunomudulação por supressão de mole´culas envolvidas na ação antiflamatória | Supresão da síntese de TNF-α., IL-1 e IL-17, prostaglandina E2, COX-1 e COX-2 | HEITZMAN et al., 2005; DIETRICH et al., 2015; GHASHEMIA et al., 2016. |
| Hidroxitirosol (Extrato de oliva) | Polifenol da oliva padronizado a no mínimo 3%, com alto potencial antioxidante, exerce efeito antiflamatório e ainda atividade antimicrobiana. | TNF-α, IL-1β, IL-6, iNOS e COX-2 além de modular IL-10. | FUCCELLI et al., 2015; HART et al., 2000; JUERGENS et al., 2004; ZHANG et al., 2009; CABRERIZO et al.,2013; PAN et al., 2013. |
| Diacereína | Antiflamatório não esteroidal com capacidade antireumatico e antiartrosico. | Reduz a síntese de metaloproteinas, prostaglandinas, tromboxanos, IL-1 e leucotrienos. | PAVELKA et al., 2016; FIDELIX et al., 2006. |
| Quercetina phytosome® | Quercetina phytosome®, padronizado a 40% de polifenólicos quercetina, o extrato vegetal ou seus constituintes são ligados a fosfolipídios, permitindo melhor melhor solubilidade e biodisponibilidade da molécula. | Modulação de vias de sinalização nos eventos e processos inflamatórios. | BAZZUCCHI et al., 2019; SIQUEIRA, 2013; LI et al., 2016; DURANTI et al., 2018; ZHENG et al., 2017; RIVA et al., 2019; CHONDROGIANNI et al., 2010; RICH et al., 2017; LI et al., 2016. |
| Curcuwin® (Curcuma longa fitossomada) | Mínimo de 20% de curcumina, processos biológicos permitiu uma molécula com biodisponibilidade 46 vezes maior em comparação a curcumina padrão. | Modulação de múltiplos alvos moleculares, proteínas de sinalização, proteínas do ciclo celular, citocinas, quimiocinas, enzimas, receptores e moléculas de adesão da superfície celular e inibe Vias de sinalização de TLR-4 e de NF-ĸB. | JAMWAL, 2018; JAGER et al., 2014; GUPTA et al., 2013; PURPURA et al., 2017; DAILY et al., 2016; HE et al., 2015; SEDDON et al., 2019; OLIVER et al., 2016. |
Referências
Allen-Hall L, Arnason J T, Cano P, Lafrenie R M. Uncaria tomentosa acts as a potent TNF-alpha inhibitor through NF-kappaB. J Ethnopharmacol. 127(3): 685-93, 2010.
Aquino R, De Feo V, De Simone F, Pizza C, Cirino G. Plant metabolites. New compounds and anti-inflammatory activity of Uncaria tomentosa. J Nat Prod. 54:453– 59, 1991.
Avni G. Desai, Ghulam N. Qazi, Ramesh K. Ganju, Mahmoud El-Tamer, Jaswant Singh, Ajit K. Saxena, Yashbir S. Bedi, Subhash C. Taneja, and Hari K. Bhat. Medicinal Plants and Cancer Chemoprevention. Curr Drug Metab. 9(7): 581–91, 2008.
Barbalho SM, Bechara MD, Quesada KR, Goulart RA. Papel dos ácidos graxos ômega 3 na resolução dos processos inflamatórios Medicina (Ribeirão Preto) 44(3): 234-40, 2011.
Barbalho SM, Goulart RA, Quesada KR, Bechara DM and Carvalho ACA. Inflammatory bowel disease: can omega-3 fatty acids really help?. Ann Gastroenterol. 29(1): 37–43, 2016.
Bazzucchi, I., Patrizio, F., Ceci, R., Duranti, G., Sgrò, P., Sabatini, S. Felici, F. The Effects of Quercetin Supplementation on Eccentric Exercise-Induced Muscle Damage. Nutrients, 11(1): 205, 2019.
Benjamin Gilbert, Rita Favoreto. Monografia de Cordia verbenacea. Revista Fitos. 7(01): 17-25, 2012.
Blanco M. L., Condino Neto, Antônio. O Fator Nuclear Kappa B: Uma nova perspectiva para o estudo de drogas anti-inflamatórias. Rev. Ciênc. Med., Campinas 12(4): 341-49, 2003.
Cameron Melainie and Sigrun Chrubasik. Oral herbal therapies for treating osteoarthritis. Cochrane Database Syst Rev.5: CD002947, 2014.
Catanzaro Daniela, Serena Rancan, Genny Orso, Stefano Dall’Acqua, Paola Brun, Maria Cecilia Giron, Maria Carrara, Ignazio Castagliuolo, Eugenio Ragazzi, Laura Caparrotta, and Monica Montopoli. Boswellia serrata Preserves Intestinal Epithelial Barrier from Oxidative and Inflammatory Damage. PLoS One. 10(5): e0125375, 2015.
Chapkin Robert S B, Wooki Kima B, Joanne R. LuptonA B, and David N. McMurraya. Dietary docosahexaenoic and eicosapentaenoic acid: Emerging mediators of inflammation. Prostaglandins Leukot Essent Fatty Acids. 81(2-3): 187–91, 2009.
Chondrogianni, N., Kapeta, S., Chinou, I., Vassilatou, K., Papassideri, I., & Gonos, E. S. Anti-ageing and rejuvenating effects of quercetin. Experimental Gerontology, 45(10): 763–71, 2010.
Chong L, Zhang W, Nie Y, Yu G, Liu L, Lin L, Wen S, Zhu L, Li C. Protective effect of curcumin on acute airway inflammation of allergic asthma in mice through Notch1-GATA3 signaling pathway. 37(5): 1476-85, 2014.
D’Acquisto Fulvio, Michael J. May and Sankar Ghosh. Inhibition of Nuclear Factor Kappa B (NF-B): An Emerging Theme in Anti-Inflammatory Therapies. MI. 2 (1), 22-35, 2002.
Daily, J. W., Yang, M., & Park, S. Efficacy of Turmeric Extracts and Curcumin for Alleviating the Symptoms of Joint Arthritis: A Systematic Review and Meta-Analysis of Randomized Clinical Trials. Journal of medicinal food, 19(8): 717–29, 2016.
David L. Scott, Steven P. White, Zbyszek Otwinowski, Wei Yuan, Michael H. Gelb, and Paul B. Sigler. Interfacial Catalysis: The Mechanism of Phospholipase A2. Science. 250(4987): 1541–46, 1990.
De Oliveira DM, Luchini AC, Seito LN, Gomes JC, Crespo-López ME, Di Stasi LC. Cordia verbenacea and secretion of mast cells in different animal species. J Ethnopharmacol. 135(2):463-68, 2011.
De Paula LC, Fonseca F, Perazzo F, Cruz FM, Cubero D, Trufelli DC, Martins SP, Santi PX, da Silva EA, A. Del Giglio Uncaria tomentosa (cat’s claw) improves quality of life in patients with advanced solid tumors. J Altern Complement Med. 21(1): 22-30, 2015.
Dietrich F, Martins JP, Kaiser S, Silva RBM, Rockenbach L, Edelweiss MIA, Ortega GG, Morrone FB, Campos MM and Battastini AMO. The Quinovic Acid Glycosides Purified Fraction from Uncaria tomentosa Protects against Hemorrhagic Cystitis Induced by Cyclophosphamide in Mice. PLoS One.10(7): e0131882, 2015.
Dinarello CA. Proinflammatory cytokines. 118(2): 503-8, 2000.
Duranti, G., Ceci, R., Patrizio, F., Sgrò, P., Di Luigi, L., Sabatini, S. Bazzucchi, I. Chronic consumption of quercetin reduces erythrocytes oxidative damage: Evaluation at resting and after eccentric exercise in humans. Nutrition Research, 50: 73–1, 2018.
Fernandes ES, Passos GF, Medeiros R, da Cunha FM, Ferreira J, Campos MM, Pianowski LF, Calixto JB. Anti-inflammatory effects of compounds alpha-humulene and (-) -trans-caryophyllene isolated from the essential oil of Cordia verbenacea. Eur J Pharmacol. 569(3): 228-36, 2007.
Fidelix, T. S. A., Soares, B., & Fernandes Moça Trevisani, V. Diacerein for osteoarthritis. Cochrane Database of Systematic Reviews. 25(1): CD005117, 2006.
Formulário Nacional Fitoterápico da Farmacopéia Brasileira, ANVISA, 1ª ed., 2011.
ant Activity of Quercetin and Its Glucosides from Propolis: A Theoretical Study. Scientific Reports 7: 7543, 2017.
Gharekhani A, Khatami MR, Dashti-Khavidaki S, Razeghi E, Noorbala AA, Hashemi-Nazari SS, Mansournia MA. The effect of omega-3 fatty acids on depressive symptoms and inflammatory markers in maintenance hemodialysis patients: a randomized, placebo-controlled clinical trial. Eur J Clin Pharmacol. 70(6): 655-65, 2014.
Ghasemian, M., Owlia, S., & Owlia, M. B. Review of Anti-Inflammatory Herbal Medicines. Advances in Pharmacological Sciences, 1–11, 2016.
Ghosh, S., May, M.J., and Kopp, E.B. NF-kappa B and Rel proteins: Evolutionarily conserved mediators of immune responses. Annu. Rev. Immunol. 16, 225–60, 1998.
Golbabaei Sanaz, Roya Bazl, Sahand Golestanian, Farzaneh Nabati, Zinat Bahrampour Omrany, Behnam Yousefi, Reza Hajiaghaee, Shamsali Rezazadeh and Massoud Amanloucorresponding. Urease inhibitory activities of β-boswellic acid derivatives. 21(1): 2, 2013.
Goneli, A.L.D.; Nasu, A.K.; Gancedo, R.; Araújo, W.D.; Sarath, K.L.L. Drying kinetics of Cordia verbenacea DC. Leaves. Rev. Bras. plantas med. 16 (2), 2014.
Gupta I, Parihar A, Malhotra P, Singh GB, Lüdtke R, Safayhi H, Ammon HP. Effects of Boswellia serrata gum resin in patients with ulcerative colitis. Eur J Med Res. 2(1): 37-43, 1997.
Gupta SC, Patchva S, Aggarwal BB. Therapeutic roles of curcumin: lessons learned from clinical trials. AAPS J. 15(1): 195–18, 2012.
Häfner AK, Gerstmeier J, Hörnig M, George S, Ball AK, Schröder M, Garscha U, Werz O, Steinhilber D. Characterization of the interaction of human 5-lipoxygenase with its activating protein FLAP. Biochim Biophys Acta. 1851(11): 1465-72, 1997.
Hartmann RM, Fillmann HS, Martins MI, Meurer L, Marroni NP. Boswellia serrata has beneficial anti-inflammatory and antioxidant properties in a model of experimental colitis. Phytother Res. 28(9): 1392-8, 2014.
Hasan Safayhi, Beatrice Rall, Eckart-Roderich Sailer and Hermann P T. Ammon. Inhibition by Boswellic Acids of Human Leukocyte Elastase. JPET. 281(1): 460-63, 1997.
He, Y., Yue, Y., Zheng, X., Zhang, K., Chen, S., & Du, Z. Curcumin, inflammation, and chronic diseases: how are they linked?. Molecules (Basel, Switzerland), 20(5): 9183–13, 2015.
Heitzman ME, Neto CC, Winiarz E, Vaisberg AJ, Hammond GB. Ethnobotany, phytochemistry and pharmacology of Uncaria (Rubiaceae). 66(1):5-29, 2005.
Illuri R, Bethapudi B, Anandakumar S, Murugan S, Joseph JA, Mundkinajeddu D, Agarwal A, Chandrasekaran CV. Anti-Inflammatory Activity of Polysaccharide Fraction of Curcuma longa Extract (NR-INF-02). Antiinflamm Antiallergy Agents Med Chem. 14(1): 53-62, 2015.
Inwald D, E G Davies and N Klein. Demystified … Adhesion molecule deficiencies. Mol Pathol. 54(1): 1–7, 2001.
Jäger, R., Lowery, R. P., Calvanese, A. V., Joy, J. M., Purpura, M., & Wilson, J. M. Comparative absorption of curcumin formulations. Nutrition journal, 13, 11, 2014.
Jamwal, R. Bioavailable curcumin formulations: A review of pharmacokinetic studies in healthy volunteers. Journal of Integrative Medicine, 2018.
Jun Sun,Yi Zhao and Jinhong Hu. Curcumin Inhibits Imiquimod-Induced Psoriasis-Like Inflammation by Inhibiting IL-1beta and IL-6 Production in Mice. PLoS One.8 (6): e67078, 2013.
Karin M, Ben-Neriah Y. Phosphorylation meets ubiquitination: the control of NF-[kappa]B activity. Annu Rev Immunol. 18: 621-63, 2000.
Kimmatkar N, Thawani V, Hingorani L, Khiyani R. Efficacy and tolerability of Boswellia serrata extract in treatment of osteoarthritis of knee–a randomized double blind placebo controlled trial. 10(1): 3-7, 2003.
o, R., L, R. Antioxid
Kliewer SA, Sundseth SS, Jones AS, Peter J. Brown, G. Bruce Wisely, Cecilia S. Koble, Pallavi Devchand, Walter Wahli, Timothy M. Willson, James M. Lenhard and Jürgen M. Lehmann*. Fatty acids and eicosanoids regulate gene expression through direct interactions with peroxisome proliferator-activated receptors α and γ. Proc Natl Acad Sci USA. 94: 4318–23, 1997.
Li, Y., Yao, J., Han, C., Yang, J., Chaudhry, M. T., Wang, S., Yin, Y. Quercetin, Inflammation and Immunity. Nutrients, 8(3): 167, 2016.
Lorente-Cebrián S, Costa AG, Navas-Carretero S, Zabala M, Laiglesia LM, Martínez JA, Moreno-Aliaga MJ. An update on the role of omega-3 fatty acids on inflammatory and degenerative diseases. J Physiol Biochem. 71(2): 341-49, 2015.
Madhu K., K. Chanda, M. J. Saji. Safety and efficacy of Curcuma longa extract in the treatment of painful knee osteoarthritis: a randomized placebo-controlled trial. Inflammopharmacology. 21(2): 129-36, 2013.
Marcheselli VL, Hong S, Lukiw WJ, Hua Tian X, Gronert K. Novel docosanoids inhibit brain ischemia-reperfusion-mediated leukocyte infiltration and pro-inflammatory gene expression. J Biol Chem 278: 43807-17, 2003.
Miyata, Arita M. Role of omega-3 fatty acids and their metabolites in asthma and allergic diseases. Allergol Int. 64(1):27-34, 2015.
Moreillon JJ, Bowden RG, Deike E, Griggs J, Wilson R, Shelmadine B, Cooke M, Beaujean A. The use of an anti-inflammatory supplement in patients with chronic kidney disease. J Complement Integr Med. 1:10, 2013.
Mur E, Hartig F, Eibl G, Schirmer M. Randomized double blind trial of an extract from the pentacyclic alkaloid-chemotype of uncaria tomentosa for the treatment of rheumatoid arthritis. J Rheumatol. 29(4):678-81, 2002.
Nahid Akhtar and Tariq M. Current nutraceuticals in the management of osteoarthritis: a review. Ther Adv Musculoskelet Dis. 4(3): 181–07, 2012.
Nahid Akhtar and Tariq M. Current nutraceuticals in the management of osteoarthritis: a review. Ther Adv Musculoskelet Dis. 4(3): 181–207, 2012.
Neyrinck AM, Alligier M, Memvanga PB, Névraumont E, Larondelle Y, Préat V, Cani PD, Delzenne NM. Curcuma longa extract associated with white pepper lessens high fat diet-induced inflammation in subcutaneous adipose tissue. PLoS One. 8(11): e81252, 2013.
Oliver, J. M., Stoner, L., Rowlands, D. S., Caldwell, A. R., Sanders, E., Kreutzer, A. Jäger, R. Novel Form of Curcumin Improves Endothelial Function in Young, Healthy Individuals: A Double-Blind Placebo Controlled Study. Journal of nutrition and metabolism, 1089653, 2016.
Palomino, D. C., & Marti, L. C. Chemokines and immunity. Einstein (Sao Paulo, Brazil), 13(3): 469–473, 2015.
Pascual Gabriel ,Amy L. Fong, Sumito Ogawa, Amir Gamliel, Andrew C. Li, Valentina Perissi, David W. Rose, Timothy Willson, Michael G. Rosenfeld and Christopher K. Glass. A sumoylation-dependent pathway mediating transrepression of inflammatory response genes by PPARγ. Nature. 437(7059): 759–63, 2005.
Pavelka, K., Bruyère, O., Cooper, C., Kanis, J. A., Leeb, B. F., Maheu, E. Reginster, J. Y. Diacerein: Benefits, Risks and Place in the Management of Osteoarthritis. An