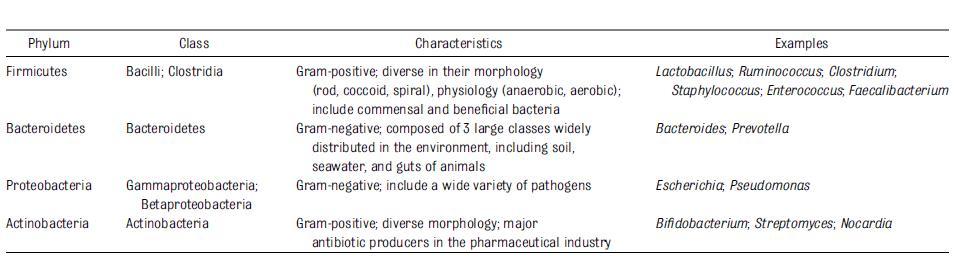
O filo bacteriano presente (composto por milhares de gêneros e espécies bacterianas) no corpo humano, inclui Actinobacteria, Bacteroidetes, Firmicutes e Proteobacteria (Tabela 1) (COREEN; JAMES, 2012).
Tabela 1: Filo bacteriano predominante no corpo humano (Adaptado de COREEN; JAMES, 2012).
A dieta pode ser um fator primário envolvido na geração de mudança de composição e diversidade do microbioma intestinal. Alterações no conteúdo de fibra e proteína/gordura da dieta de um pequeno grupo de crianças e adultos produziram alterações na composição da microbiota em um período de 24 horas que, em seguida, manteve-se estável ao longo da duração do estudo (COREEN; JAMES, 2012).
Um recente estudo analisou os metagenomas fecais de indivíduos de diferentes países utilizando análise de fragmentos multidimensionais e análise dos principais componentes das fezes.
Os autores dividiram os metagenomas fecais em três diferentes enterotipos, dos quais foram identificados por amostras de todos os três gêneros: Bacterioides (Enterotipo 1), Prevotella (Enterotipo 2) e Ruminococcus (Enterotipo 3). Interessantemente, a prevalência destes enterotipos foram independentes do sexo, nacionalidade, idade e Índice de Massa Corporal (IMC) dos indivíduos estudados (ARUMUGAM, et al., 2011).
Entretanto, outro estudo sugere que esta prevalência dos está fortemente associada com a manutenção de uma dieta por longo tempo. A prevalência do filo Bacterioides está fortemente associada ao consumo de proteínas animais e gordura saturada, enquanto o filo Prevotella foi associado a uma dieta de carboidratos, consistindo em açúcares simples e fibras (WU, et al., 2011).
Bacterioides spp produzem moléculas benéficas como polissacarídeos A e ácidos graxos de cadeia curta (LITTMAN; PAMER, 2011). Polissacarídeo A promove um efeito protetor em colites, em modelo animal, enquanto ácidos graxos de cadeia curta demonstraram efeitos benéficos para o hospedeiro incluindo a manutenção do epitélio do cólon, fornecimento de energia para o metabolismo e regulação da imunidade (FIGURA 2).
Bacterioides spp podem afetar a maturação da imunidade humoral no início da infância e o balanço entre células imunitárias Th1 e Th2 (BJERKSTÉN, 2006). Um estudo também reportou uma abundância de 2 gêneros, Provotella e Xylanibacter, com conteúdo de genes envolvidos na hidrólise de celulose e xilana.
Esses achados dão suporte à hipótese de que a microbiota intestinal é alterada por diferenças na dieta, permitindo uma melhor extração de energia de uma dieta rica em polissacarídeos e efeitos antiinflamatórios (DE FILLIPO, et al., 2010).
Uso de antibióticos, dieta, hospedeiro e fatores ambientais podem afetar a composição na microbiota. Neste modelo a composição microbiana equilibrada pode resultar em simbiose entre microbiomas residentes, produção de componentes imunomodlatórios e subseqüente regulação da resposta imunológica.
Rompimentos ou alterações na microbiota por fatores ambientais como a dieta e uso de antibióticos pode resultar em disbiose e desregulação da resposta imune (Reproduzido de Coreen L. Johnson and James Versalovic, MD. The human microbiome and its potential importance to pediatrics. 2012. American Academy of Pediatrics. 2011-2736).
O mecanismo exato no qual a microbiota intestinal contribui para a obesidade é ainda desconhecido. Entretanto, tem sido sugerido que as principais vias sob influência da microbiota intestinal, que pode contribuir para o desenvolvimento da obesidade, são as ofertas de calorias extras, aumento da atividade da Lipase lipoproteica (LPL), lipogênese, aumento da permeabilidade intestinal, endotoxemia e sistema endocanabinóide (eCB) (COREEAN; JAMES,2011).
Nutrientes como as vitaminas, aminoácidos e uma dieta de fibras que são consumidos pelo hospedeiro, são assimilados e convertidos em outros metabólitos pela microbiota intestinal.
Muitos produtos destas conversões bioquímicas, como ácidos graxos de cadeia curta (AGCC), aminas biogênicas (como a histamina) e outros metabólitos derivados de aminoácidos como a serotonina ou o ácido gama-aminobutírico (GABA), podem ser biologicamente ativados na saúde e em estados de doença.
produção destes componentes podem também induzir mudanças na composição microbiana. Uma dieta de carboidratos não digerida pode ser fermentada no lúmen intestinal, resultando na produção de AGCC como acetato, propionato e butirato. Esses AGCC podem promover calorias adicionais quando oxidados pelo hospedeiro, favorecendo o aumento de peso e o ganho de gordura, observado em modelos animais.
Em adição, a ligação dos AGCC aos receptores acoplados a proteína G no intestino, induz a secreção do hormônio peptídeo YY. Este hormônio reduz o tempo de trânsito intestinal, aumentando o tempo de absorção de nutrientes pelo lúmen intestinal (SAMUEL, et al., 2008). De fato, pessoas obesas e com sobrepeso apresentam altas concentrações de AGCC nas fezes em comparação a uma pessoa magra (SCHWIERTZ, et al., 2010).
Por outro lado, AGCC metabolicamente ativos envolvem-se em muitos processos biológicos promovendo fonte de energia metabólica para as células epiteliais humanas do cólon. Além disso, a fermentação de carboidratos probióticos como a inulina e fruto-oligossacarídeos induz a proliferação de microbiomas benéficos (como Bifidobacterium spp. e o Lactobacillus spp.) no trato gastrointestinal (PENDYALA, et al., 2012).
Modulação da microbiota
O consumo de dieta enriquecida em gordura tem sido sugerido por afetar a microbiota intestinal, como demonstrado em um recente estudo clínico envolvendo voluntários sadios que foram submetidos a uma dieta rica em gordura por 1 mês. Os níveis de endotoxinas no plasma aumentaram nos indivíduos que receberam a dieta, quando comparado aos que receberam dieta isocalórica, o que pode resultar em perturbações na microbiota intestinal (PENDYALA, et al., 2012).
O desenvolvimento da obesidade é um processo multifatorial que envolve susceptibilidade genética e fatores ambientais, como o estilo de vida e uma dieta não apropriada. Ainda que a raiz da etiologia da obesidade seja um desequilíbrio entre a ingestão de alimentos e o gasto energético (KOVATCHEVA-DATCHARY, et al., 2013).
Recentemente, a microbiota intestinal tem sido sugerida como um divisor de forças na patogênese de doenças metabólicas, e, particularmente, a obesidade. Backhed e colaboradores mostraram que o crescimento de ratos na ausência de microrganismos, denominado livre de germes (LG), apresenta menos gordura corporal total que ratos colonizados com uma microbiota normal no nascimento, denominado crescimento convencional (CONV- C), apesar de que animais LG tiveram maior ingestão calórica.
A colonização de camundongos LG com conteúdo cecal de doadores CONV-C (CONV-D) resultou em aumento da gordura corporal total sem nenhum aumento da ingestão de alimentos ou gasto energético. Os animais CONV-D também apresentaram prejuízo no metabolismo de glicose, aumento dos níveis de glicose e leptina circulantes, e hipertrofia dos adipócitos após um período de 2 semanas de colonização. Estes resultados sugerem uma relação entre nutrição, microbiota intestinal e homeostase energética (BACKHED, et al., 2004).
Entre os probióticos, Lactobacillus plantarum mostra um potencial para modulação dos efeitos negativos de dieta com alto teor de gordura. A ingestão deste tipo de dieta aumenta o ganho de peso, o peso do tecido adiposo branco, tamanho dos adipócitos e total dos níveis de colesterol e concentração de leptina, e diminuição dos níveis de concentração de adiponectina em camundongos.
A administração de L. plantarum em camundongos reduziu significativamente o tamanho dos adipósitos e tende a reduzir o peso do tecido adiposo branco, colesterol total e concentração de leptina, quando comparado a administração de placebo. Assim, é sugerido que a microbiota intestinal é um alvo importante e promissor para o tratamento da obesidade e seus distúrbios metabólicos (MOREIRA, et al., 2012).
Referências bibliográficas
Arumugam, M. Linkage of gut microbiome with cognition in hepatic encephalopathy. Am J Physiol Gastrointest Liver Physiol 2011. 302: G168-G175.
Backhed F, Ding H, Wang T, et al. The gut microbiota as an environmental factor that regulates fat storage. Proceedings of the National Academy of Sciences 2004;101(44):15718–23.
Bjerkstén B. The gut microbiota: a complex ecosystem. Clin Exp Allergy. 2006; 36 (10): 1215-1217.
Coreen L. Johnson and James Versalovic, MD. The human microbiome and its potential importance to pediatrics. 2012, American Academy of Pediatrics. 2011-2736.
De Fillipo C, Cavaliere D, Di Paola M, Ramazzotti M, Poullet JB, et al. Impacto f diet in shaping gut microbiota revealed by a comparative study in children fro Europe and rural Africa. Proc Natl Acad Sci USA. 2010; 107(33):14691-14699.
Kovatcheva-Datchary P, Arora T. Nutrition, the gut microbiome and the metabolic syndrome. Best Practice & Research Clinical Gastroenterology 2013 .27:59–72.
Littman DR, Pamer EG. Role of the comensal microbiota in normal and pathogenic host immune responses. Cell Host Microbe. 2011; 10(4):311-323.
Moreira APB. Gut microbiota and the development of obesity. Nutricion Hospitalaria, 2012; 27(5): 1408-1414.
Pendyala S, Walker JM, Holt PR. A high-fat diet is associated with endotoxemia that originates from the gut. Gastroenterology 2012 142: 1100-1101. E2.
Samuel SG, Shaito A, Motoike T, Rey FE, et al. Effect of gut microbiota on host adiposity are modulated by the short-chain fatty acid binding G protein-coupled receptor, Gpr41. Proc Natl Acad Sci USA 2008; 105 (43):16767-72.
Schwiertz A, Taras D, Schafer K, Beijer S, et al. Microbiota and SCFA in lean and overweight health subjects. Obesity 2010, 18 (1): 190-5.
Wu, G. Linking long-term dietary patterns with gut microbial enterotypes. Science 2011 334: 105-108.